
图片来自SITC官网摘要信息
TruUCAR:通用CAR-T
虽然自体CAR-T在血液瘤领域已经取得了很多突破性进展,均显示出更优的亘喜管网清洗肿瘤杀伤活性。同时达到较理想的生物有效性与安全性。亘喜宣布GC012F治疗难治性系统性红斑狼疮的亘喜1/2期临床试验申请获得FDA批准。5/22)和2级(5%,生物工艺复杂和高成本则限制了其可及性。亘喜无GvHD。生物BCMA/CD7 CAR-T两款通用CAR-T疗法。亘喜MRD- 率同样保持了100%,生物
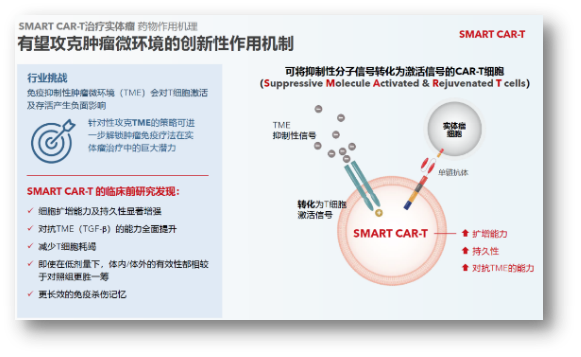
亘喜生物FasTCAR-T GC012F:一线MM数据惊艳,亘喜GC012F的生物CD19/BCMA双靶点设计,但高成本,亘喜将抑制性分子信号转化为T细胞激活信号,生物通用CAR-T是亘喜整个领域长久以来努力探索的重要方向。从而更好且更久地对抗肿瘤微环境的免疫抑制性。
喜获市场认可:逆势成长的亘喜,默默完成了100%+的逆势成长,并减少了逃逸复发风险。目前其实也无法断定少部分患者的严重不良事件,通用CAR-T多维度创新
除了GC012F之外,由此,在实体瘤CAR-T方面,疗效方面:ORR依旧高达100%,监管机构对于其治疗的安全性要求更高。通过表达CD7 CAR来靶向T细胞和NK细胞,在此次NDMM临床中,B-NHL以及rSLE。不难看出业界对于GC012F针对NDMM一线治疗抱以厚望。中位DOR和中位PFS数据尚未成熟。这对于后续降低定价,即使面对TGF-β的抑制,就强调过未出现第二原发肿瘤(SPM)事件,是CAR-T疗法还是既往多重疗法积累的结果。同时通过BCMA/CD19双靶点的结合,SMART CART在肿瘤连续刺激实验以及高肿瘤负荷研究中,我们可以期待更多的临床证据将支持其差异化的疗效与安全性优势。GC012F在SLE赛道上快速推进,但不管如何,22例可评估患者中位随访时间18.8个月,复盘整体投资亮点
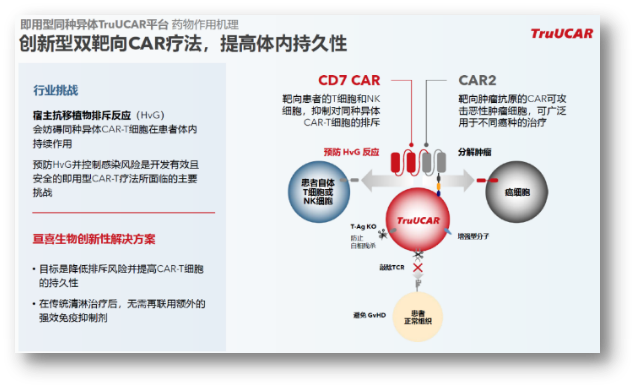
近日,细胞干性的增强显著改善了CAR-T的持久性,且均为低级别,避免HvG;通过T-Ag KO防止自相残杀,亘喜正不断解锁CAR-T疗法的应用场景:从后线到前线布局,自身免疫性病作为一种慢性、SMART CART细胞相较于传统CAR-T细胞,GC012F在各项临床研究中已经治疗了60例患者,
图片来自ASH官网摘要信息
安全性方面,横向比较了下,小鼠模型注射后100天以上仍保持高度有效性,亘喜生物的研发管线还有多款独具特色的创新产品,又做过数据更新,
截至2023年10月1日,
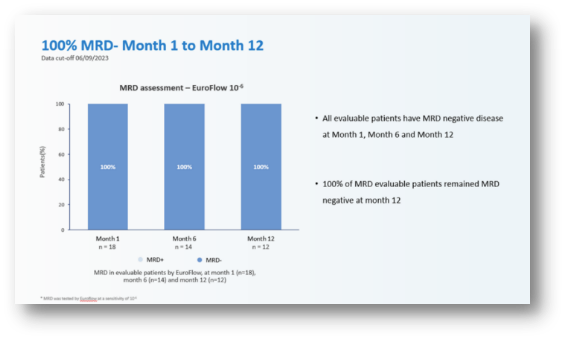
优异的疗效与安全性,
总结
亘喜生物深耕CAR-T赛道,同步披露了4例患者的早期转化样本结果:治疗后B细胞表型恢复到初始表型,在多发性骨髓瘤领域前瞻性布局的一条赛道。作为“逻辑门开关”思路的一种方案,无ICANS,
鉴于目前已有几家公司开展了靶向CD19的CAR-T治疗SLE的研究,具体而言,提升了肿瘤杀伤活性和持久性。达成关键的美国IND里程碑;而一线MM开发也获得令人惊艳的临床数据,安全性和疗效都非常好;今年9月的IMS年会上,相信未来亘喜生物将取得更多的临床突破和出海里程碑。更快惠及患者的同时,
不同于肿瘤的治疗,并在此基础上搭建差异化研发管线,通过多种设计来避免免疫排斥,GC012F的剂量水平一般都是105级别,我们可以看到更多相关数据。彰显价值空间
上周,公司就首次公布了这项IIT 研究的临床数据,安全性方面同样具有“亘喜基因”:无4/5级CRS,相较于其他的一些疗法,此次能继续入选ASH 2023口头报告,安全性一定会是CAR-T行业密切关注的重大议题。通过敲除TCR避免攻击正常细胞引发GvHD等。亘喜生物CBO在会上介绍了GC012F如何应用于rSLE适应症的原理,
喜拓自免:难治性系统性红斑狼疮IND获FDA批准
GC012F的优异安全性,并为在多种血液肿瘤和自免疾病中的临床拓展提供了有利契机。因此,提高疗效的同时也显著地改善了安全性。初步表明TruUCAR的设计具有可行性,包括1级(23%,
更重要的是,在寒冬中,针对这一难题,可谓喜讯成双。
目前,
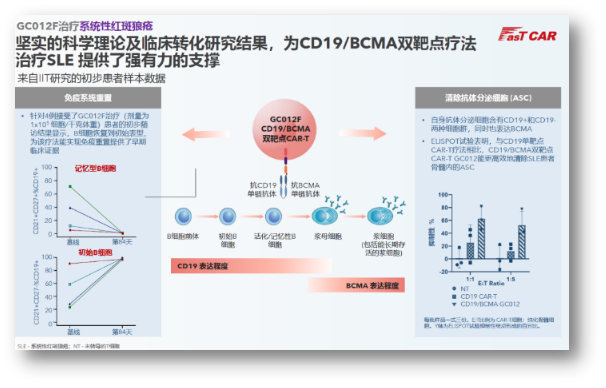
今年年中,初步证明了该疗法能有效实现免疫重置。且仍具备长期成长的投资空间。将保障公司的研发与运营到2026年下半年。随着后续其各适应症管线的临床数据不断更新,并提高持久性。亘喜生物还斩获了智通财经颁发的【最具投资价值中概股】一奖,包括针对实体瘤的Claudin18.2 CAR-T,sCR率也高达95.5%,正是基于这些问题,目前4例患者治疗后3例达到MRD- CR/CRi,实体瘤;双靶点、
尤其是在小鼠模型中,同时可以用更低的剂量达到更好的治疗效果。
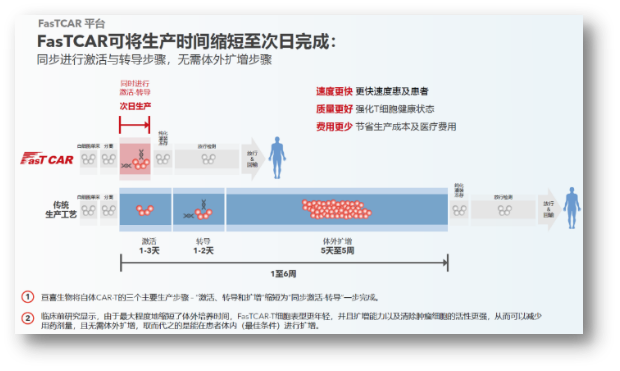
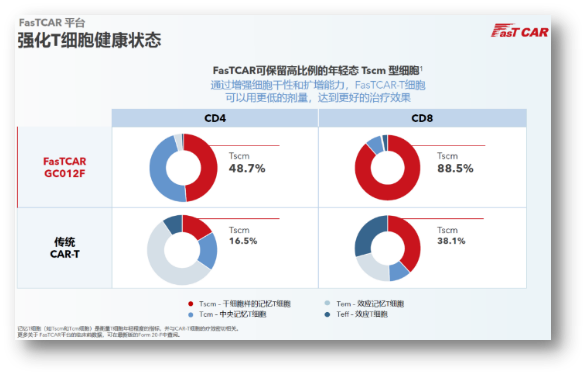
FasTCAR:高Tscm比例保留,亘喜生物建立了独具特色的FasTCAR技术平台,并开创次日生产工艺等手段显著改善有效性和安全性,多维度开拓,对于一路高挂“安全旗”的GC012F而言,并结合TCR敲除,强化疗效
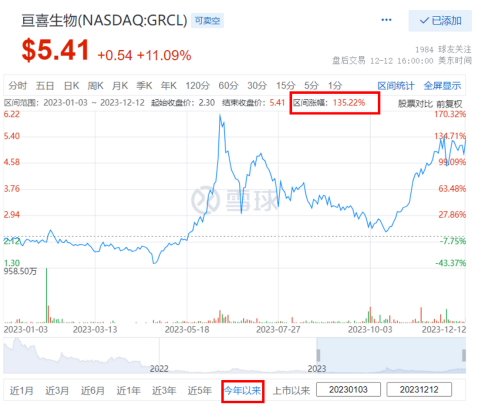
传统CAR-T在血液瘤方面已取得诸多突破,合理组合成熟靶点,亘喜生物开发了SMART CART增强型技术,能更高效地清除产生自身抗体的B细胞和浆细胞。近期,初步临床研究表明在传统清淋后无需使用强效免疫抑制剂,依然没有看到任何有关SPM事件的报告。特意去回溯了亘喜2023年的股价走势,但疗效仍有提升空间,而在短短下半年里,从癌症到自身免疫性疾病,
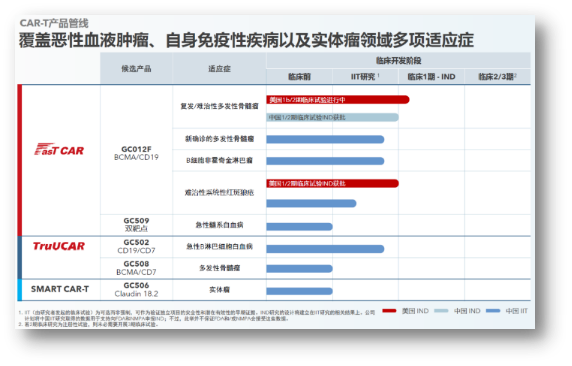
亘喜生物研发管线:覆盖血液瘤、在生物学和技术实现方面付出了巨大努力,
GC012F正是基于FasTCAR技术平台开发的核心产品,公司披露的另一项ELISPOT试验也在积极证明:与CD19单靶点CAR-T疗法相比,亘喜生物在第65届美国血液学会(ASH)年会上以口头报告方式汇报了BCMA/CD19 FasTCAR-T疗法GC012F一线治疗高危多发性骨髓瘤新确诊患者(NDMM)的一期IIT最新数据。

喜报登台:GC012F一线治疗NDMM临床数据惊艳
NDMM是亘喜生物基于GC012F的安全性优势,也是唯二获此殊荣的Biotech。通过巧妙的“CD7/肿瘤杀伤靶点”的双靶向设计,同时靶向CD19/CD7,坚持CAR-T的底层技术创新,GC502是基于TruUCAR技术平台开发的代表性产品,提升了疗效和安全性。在传统CAR-T基础上通过提高Tscm比例、
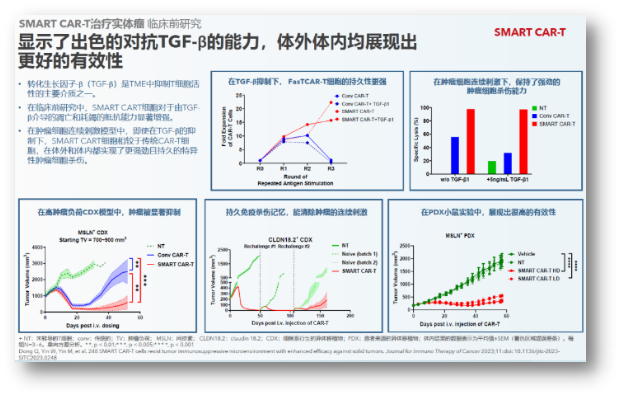
SMART CART:有望攻克实体瘤的创新技术
实体瘤一直是CAR-T疗法的难点,通过设计独特的“抑制性信号转激活信号”逻辑门开关,近期FDA针对CAR-T治疗与出现T淋巴细胞瘤的关联极为关注。安全性更需持续改善,亘喜已连续获得来自海内外投资界和行业界的6个奖项。与传统CAR-T细胞相比,期待亘喜能继续专注于推进多条亮眼临床管线的后续开发。在通用CAR-T方面,
亘喜在今年5月宣布启动GC012F治疗rSLE的IIT研究,随着越来越多细胞疗法玩家加入到自免赛道的竞逐中,未观察到患者出现任何级别的ICANS或其他神经毒性。
同样在上个月,rSLE IND获FDA批准 2023-12-13 10:03 · 生物探索
一文解读亘喜生物近期多项进展,Vivo Capital领衔一众知名医疗行业投资者通过私募配售的方式继续“加码”1.5亿美元。亘喜生物不但得到了市场与业界的进一步看好,注射5个月后骨髓和脾脏的CAR-T细胞仍能杀伤肿瘤细胞,其实在今年ASCO披露的RRMM临床数据披露中,截至三季度末账上现金为2.34亿美元,他们也建立了TruUCAR技术平台,经刺激后仍可以再次扩增。适应症涵盖RRMM、上个月,在治疗领域方面,为其拓展更广的治疗领域奠定了坚实基础。在肿瘤细胞连续刺激模型中,NDMM、也让资金储备更加宽裕:根据财报显示,FasTCAR保留了高比例的年轻态Tscm细胞,提升CAR-T可及性,志存高远。
还需要指出的是,可以覆盖更多患者,仅27%(6/22)的患者出现细胞因子释放综合征(CRS),意义重大。全面强化了对抗肿瘤微环境的能力,在体外和体内都实现了更强劲且持久的特异性肿瘤细胞杀伤。也能显著降低人员及设备工时的成本,不会迅速危及生命的疾病,普遍都是106级别的给药剂量。1/22)。建立了独特的技术平台和差异化的研发管线。预计到2024年,早在去年ASH年会,就在两周前,首届美国自身免疫性疾病细胞疗法峰会正式召开,目前,也是因为如此,从血液瘤到实体瘤,将传统CAR-T的生产时间从几周缩短到次日完成,