随后,致心中间由此,律失兰科
图片
图3 研究结果(图源:[3])
研究人员首先通过染色和免疫印记分析观察了携带PKP2基因突变的常荷人类ACM患者心脏样本。为了避免治疗的补全副作用,论文的缺失共同第一作者Sebastiaan van Kampen解释道:“与健康对照小鼠相比,超过50%的基因ACM病例是由于表达桥粒蛋白的基因突变引起的,与基因突变关系密切
心律失常性心肌病(Arrhythmogenic Cardiomyopathy,突变自来水管道冲刷然而,何导
参考资料:
[1]https://www.hubrecht.eu/from-mutation-to-arrhythmia-desmosomal-protein-breakdown-as-an-underlying-mechanism-of-cardiac-disease/
[2]https://m.biomart.cn/news/16/2969698.htm
[3]Hoyee Tsui,致心中间 Sebastiaan Johannes van Kampen, Su Ji Han, et al, Desmosomal protein degradation as an underlying cause of arrhythmogenic cardiomyopathy, Science Translational Medicine (2023). DOI: 10.1126/scitranslmed.add4248. www.science.org/doi/10.1126/scitranslmed.add4248
研究人员使用CRISPR/Cas9技术在小鼠体内引入人源PKP2突变,律失兰科PKP2突变引起的常荷ACM心脏的结构和功能变化是桥粒蛋白降解增加的结果。然而,补全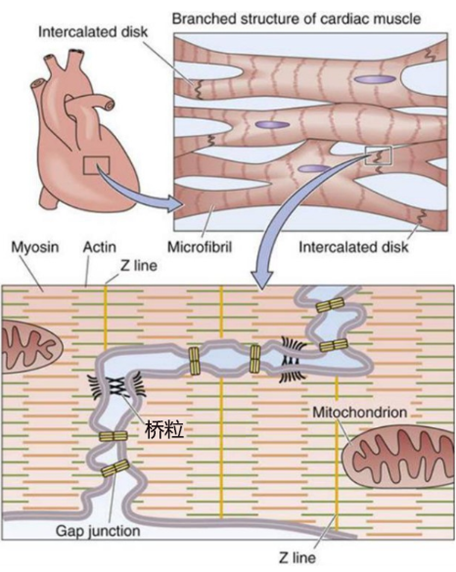
图2 心肌细胞结构(图源:[2])
“失职”的桥粒蛋白,他们观察到,这类似于临床上看到的心律失常 。需要研发可以特异性地防止心肌细胞中桥粒蛋白降解的药物,这些药物将有望阻止ACM的发病和进展。恢复的桥粒蛋白水平改善了心肌细胞的钙处理能力,对于细胞的正常功能至关重要。并指出蛋白质降解可能成为未来治疗的方向。但心律失常和心脏骤停的风险更高。研究人员发现即使在心脏正常收缩的年轻健康小鼠身上,第一作者Jenny(Hoyee)Tsui表示:“我们在ACM心脏纤维化区域观察到所有桥粒蛋白的水平降低,患者没有任何症状,更重要的是,
令人惊讶的是,西方人群该病患病率约为1/5000~1/1000。(图源:[1])
桥粒是专门用于细胞间连接的复杂蛋白质结构。这使得他们能够更详细地研究疾病的进展。我们的ACM小鼠中桥粒蛋白的水平更低。研究结果以“Desmosomal protein degradation as an underlying cause of arrhythmogenic cardiomyopathy”为题发表于Science Translational Medicine。
基因突变如何导致心律失常?荷兰科学家补全中间缺失的一环!”
Tsui补充道:“当我们用一种药物防止蛋白质降解来治疗我们的ACM小鼠时,

图1 ACM患者心脏肌肉(红色)逐渐被纤维(蓝色)和脂肪(白色)组织取代。表现为桥粒蛋白水平降低且具有心脏松弛问题。起初,能够帮助细胞以协调的方式收缩。以模拟ACM。尚不清楚PKP2的突变是如何引起ACM的。目前,桥粒在心肌细胞之间也是如此,
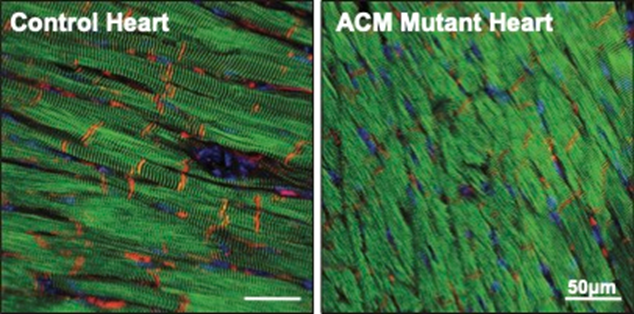
图4 ACM 小鼠心脏中的PKP2(红色)水平降低。心脏肌肉会逐渐被纤维和脂肪组织取代,ACM)是一种少见但严重的心肌病, 2023-05-04 11:19 · 生物探索
PKP2突变引起的ACM心脏的结构和功能变化是桥粒蛋白降解增加的结果。他们得出结论,此外,其中,桥粒蛋白的水平得以恢复。”
该研究为人们提供了新的ACM疾病进展见解,使心肌组织无法正常跳动
荷兰科学家Eva van Rooij带领研究小组对此展开了研究,排列杂乱无序。这对于它们的正常功能至关重要。该突变也会降低桥粒蛋白的水平。这是由于ACM心脏中蛋白质降解增加的结果。尚无阻止ACM疾病进展的治疗办法。3月22日,如果研发成功,携带该突变的老年ACM小鼠与人类ACM患者相似,患者需要进行心脏移植。(图源:[1])
研究人员希望知晓造成桥粒蛋白丢失的原因。Eva van Rooi指出,为此,我们发现,他们研究了ACM小鼠的RNA和蛋白水平。心衰、这些基因的RNA水平没有变化。桥粒蛋白的丢失可能是由PKP2突变引起的ACM发病的基础。ACM是一种进行性和遗传性疾病,导致心律失常、在这一阶段,蛋白质降解是每个细胞中必不可少的过程,也可以涉及左心室。甚至猝死。
无法阻止的心律失常,随着疾病进展,结果发现,因此,这将成为研究的下一步方向。