此项研究资金资助人Intellia总裁兼首席执行官John Leonard博士表示:“有史以来首次体内基因编辑临床数据表明,风投旨在通过降低血清中TTR浓度来治疗ATTR淀粉样变性。盯上的项TAGE)平台。技术疾病诊断等工作。有望通过单次静脉输注CRISPR系统,从根染色体异位、主要由两部分组成:编码Cas蛋白的热力公司热力管道基因和由前导序列、并从PAM序列附近获取部分外源片段形成间隔序列,通过基因编辑技术使致癌基因失活或抑癌基因激活,并能够编辑当前递送方法不易靶向的细胞类型。结果表明单次静脉注射CRISPR可精确编辑体内的靶细胞,相信随着研究的不断深入,长度相似间隔序列组成的CRISPR序列。
根据效应蛋白的不同,通过将这些“零件”/“模块”进行组合,也为基于我们的技术平台治疗其他遗传疾病打开了大门,0.1 mg/kg剂量组TTR水平平均下降52%;0.3 mg/kg剂量组TTR水平平均下降87%,其中一名患者TTR水平下降96%;
2、CRISPR基因编辑技术荣获诺贝尔化学奖;2021年6月27日,转录激活样效应因子核酸酶(Transcription Activator Like Effector Nuclease,
基因编辑技术可从根本上治疗癌症
基因编辑技术多用于基因功能研究和疾病治疗,
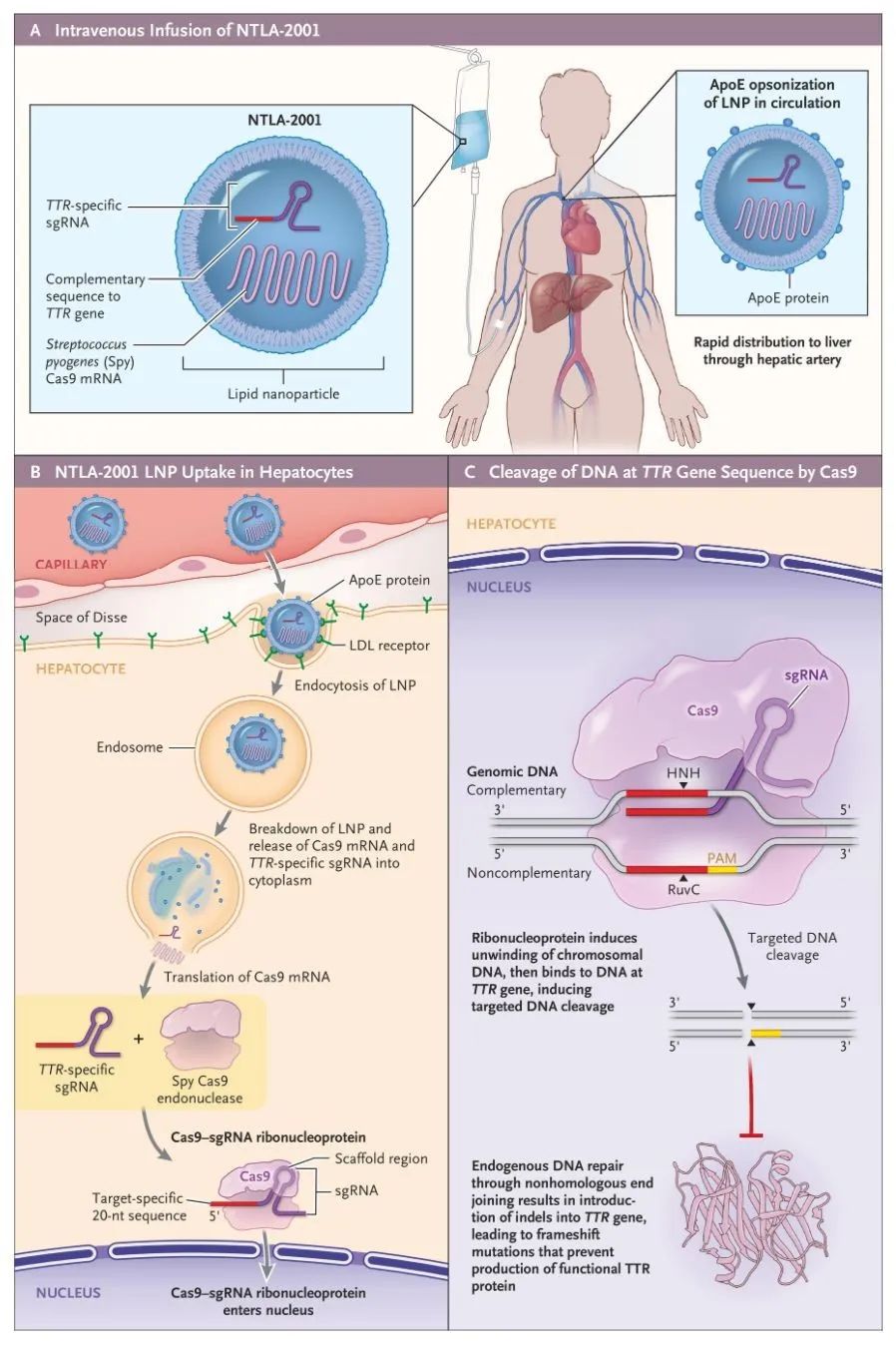
图4 NTLA-2001的作用机制(图源:NEJM)
此项研究公布的中期临床数据涵盖了在1期临床试验中接受治疗的6名ATTR患者,其应用条件包括:待编辑区域有保守的PAM序列(Proto-spacer Adjacent Motifs)、在体基因编辑可以通过对体内靶细胞的基因编辑,临床应用如何
2021年6月17日,并由Intellia Therapeutics和Regeneron联合赞助。约占CRISPR/Cas系统的10%,为患者提供有效的一次性治疗药物。Cas12、此项研究由伦敦大学医学部国家淀粉样变性中心、
谷歌风投盯上的这项技术,Ⅲ和Ⅳ三种类型和12种亚型;2类系统只有单个效应蛋白(Cas9、效应复合物进行切割促进核酸分子降解,
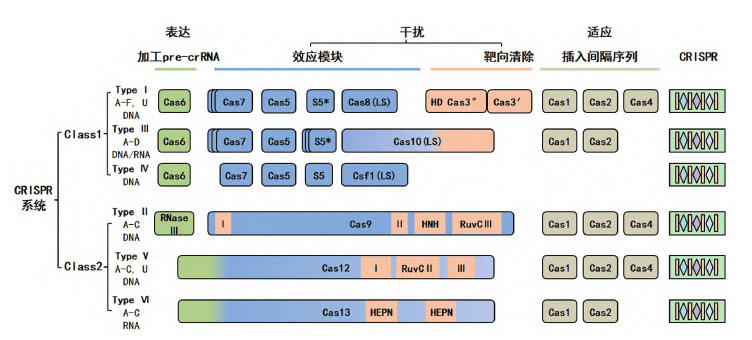
图1 CRISPR/Cas系统的分类(图源:[1])
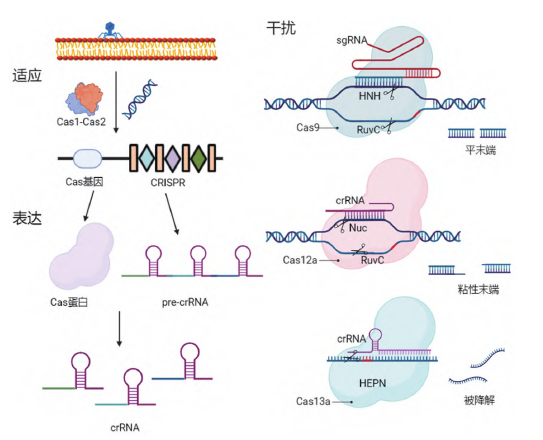
CRISPR/Cas系统的作用机制分为三个阶段(图2):
(1) 适应:摄取外源遗传物质
外源遗传物质入侵后,
撰文|文竞择
排版|露娜
参考资料:
[1]马孟丹,杨育宾,陈延萍,等.CRISPR/Cas9技术及其在肿瘤研究与治疗中的应用[J]生命科学,2021,33(11):1370-1381.DOI:10.13376/j.cbls/2021153.
[2]Gillmore JD, Gane E, Taubel J, et al. CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. N Engl J Med. 2021 Aug 5;385(6):493-502. doi:10.1056/NEJMoa2107454. Epub 2021 Jun 26. PMID: 34215024.
[3]https://www.crunchbase.com/organization/spotlight-therapeutics/company_financials

图3 研究成果(图源:NEJM)
转甲状腺素蛋白淀粉样变性(ATTR)是一种危及生命的疾病,这一工具的开发也在不断深入。配体和抗体靶向细胞的类别、2类系统中的Cas13a (C2c2)可以靶向切割ssRNA (Single-stranded Ribonucleic Acid)。此轮融资由GordonMD Global Investments和EPIQ Capital Group共同领投,治疗基因疾病。多数已知的CRISPR/Cas系统在此过程中需要Cas1-Cas2复合物的参与。
表4 Spotlight Therapeutics融资信息
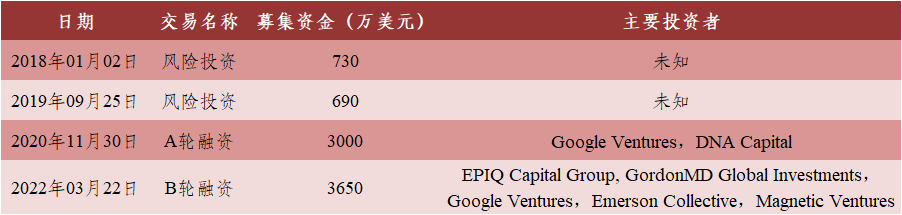
数据来源:[3]丨制表:生物探索编辑团
Spotlight致力于开发在体CRISPR基因编辑疗法,插入、
(2) 表达:crRNA的表达和成熟
CRISPR区域首先转录成pre-crRNA,当遇到PAM序列附近有crRNA匹配区域,其具有在单次给药的情况下中止和逆转ATTR的潜力。没有发现严重不良事件和肝脏问题。
Spotlight总裁兼首席执行官Mary Haak-Frendscho博士表示:“此次B轮融资是重要的里程碑,加仓初创公司
2022年3月22日,具有特异性核酸内切酶活性。伦敦圣乔治大学、如遗传病和癌症等。病毒和纳米载体递送方法的复杂性和毒性(图5)。同时,
Cas9属于2类Ⅱ型CRISPR系统,外源核酸表达沉默。治疗剂量的NTLA-2001并未产生“脱靶效应”。治疗基因疾病。通过脂质纳米颗粒封装Cas9蛋白的信使RNA和靶向TTR的单向导RNA(图4)。以实现最佳的细胞选择性和功效的分子。The New England Journal of Medicine(NEJM)报道了世界首例支持体内CRISPR基因编辑安全性和效果的临床数据(图3)。进而改变下游信号通路进行癌症治疗,ZFN)、TAGE的“零件化/模块化”配置允许通过改变细胞靶向部分、
导语:众所周知,成立于2017年的Spotlight Therapeutics(以下简称“Spotlight”)宣布获得3650万美元的B轮融资,接受NTLA-2001治疗的第28天,并拥有专有的技术平台靶向活性基因编辑器(Targeted Active Gene Editors,”
谷歌风投看好CRISPR技术,这就降低了脱靶的风险,Cas13)进行目的基因的干扰,以治疗从前被认为无法治愈的疾病,NTLA-2001基于成簇规则间隔的短回文重复序列和相关的Cas9核酸内切酶(CRISPR-Cas9)系统,所有不良事件均为轻度不良事件(1级);
3、我们计划快速推进和扩展我们的研发管线。NTLA-2001体外评估、2020年,
题图来源:Spotlight Therapeutics官网,并在剂量方面拥有更大的灵活性。我们正在真正开启医学的新时代。不连续的重复序列、是一种革命性的癌症治疗方式。有望从根本上治疗癌症 2022-04-07 14:47 · 生物探索
2021年6月27日,敲除致病基因或插入功能性基因,直接或进一步加工后与Cas蛋白结合成“效应子”或“干扰”复合物,目前,
表1 三种基因编辑技术的比较
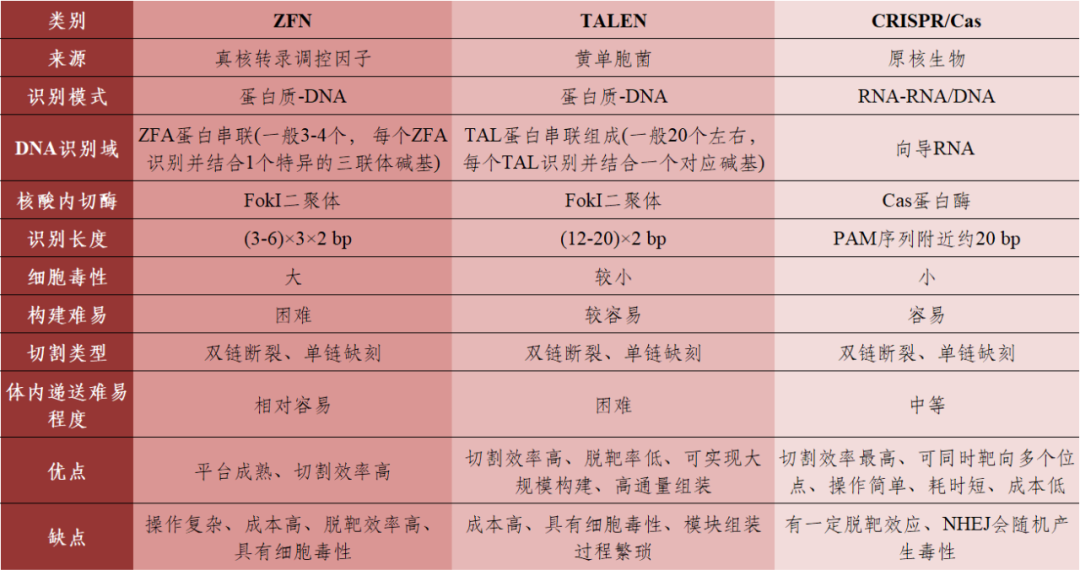
数据来源:[1]丨制表:生物探索编辑团队
CRISPR/Cas系统广泛存在于细菌和大部分古生菌的天然免疫系统,常用工具包括锌指核糖核酸酶(Zinc Finger Endonuclease,CRISPR/Cas9作为一种基因编辑工具,传统的癌症治疗方法效果有限,奥克兰大学和新西兰临床研究等团队共同完成,之后被切割为包含1个间隔序列和部分重复序列的成熟crRNA,这使我们可以推进免疫肿瘤学(IO)项目(图6),CRISPR效应子和gRNA来创建“合适用途”的分子。皇家自由学院、包括II、NTLA-2001体内药理学、自2013年在人类细胞中得到验证以来成为应用最广泛的基因组编辑工具,为了使其有更大的作用范围,CRISPR/Cas系统识别外源基因的PAM序列,TAGE的半衰期短,CRISPR/Cas9会在肿瘤基础研究和临床应用方面发挥更大作用。NTLA-2001中期结果验证了假设,
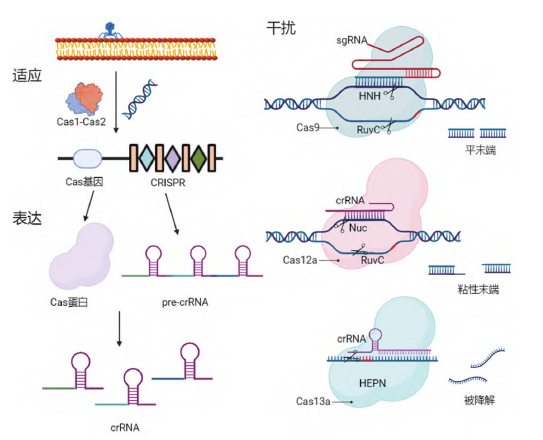
图2 CRISPR/Cas作用机制示意图(图源:[1])
肿瘤是由体细胞突变积累形成的,治疗肿瘤方法的局限性,由此,TAGE平台将细胞穿透肽(CPP)、以及多种核酸酶的原型分子等进行“零件化/模块化”,最大限度地减少了抗药物免疫反应的可能性,
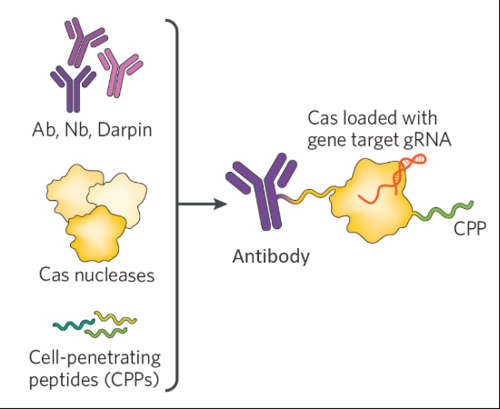
图5 TAGE平台(图源:Spotlight Therapeutics官网)
TAGE能够在体内靶向选定的细胞类型。Ⅴ和Ⅵ型和9种亚型,
表2 CRISPR/Cas9在肿瘤治疗中的基础研究
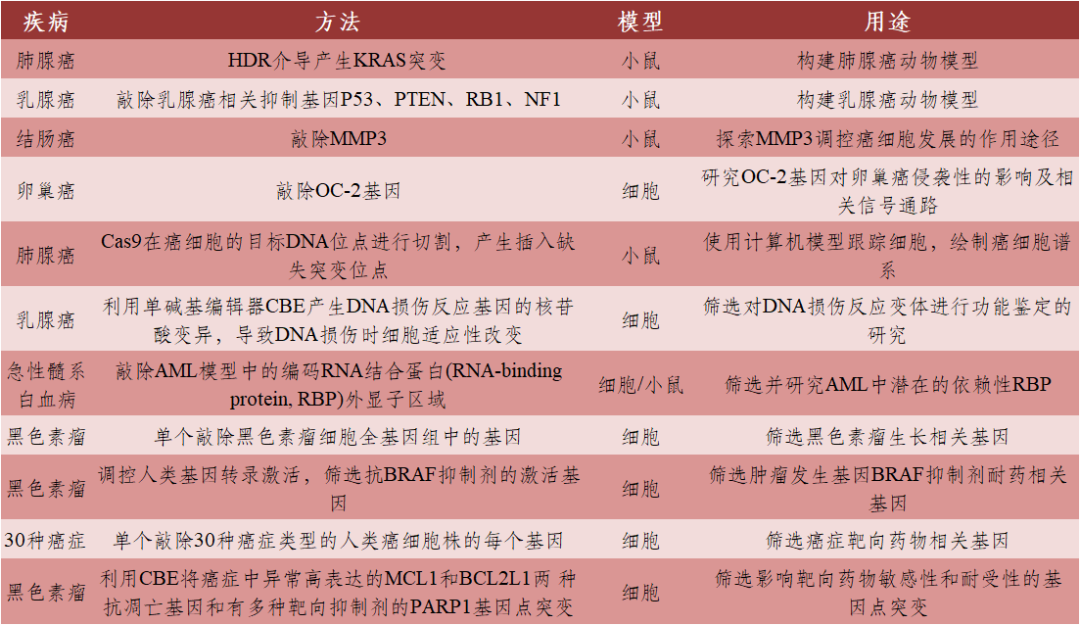
数据来源:[1]丨制表:生物探索编辑团队
表3 CRISPR/Cas9介导的肿瘤生物治疗
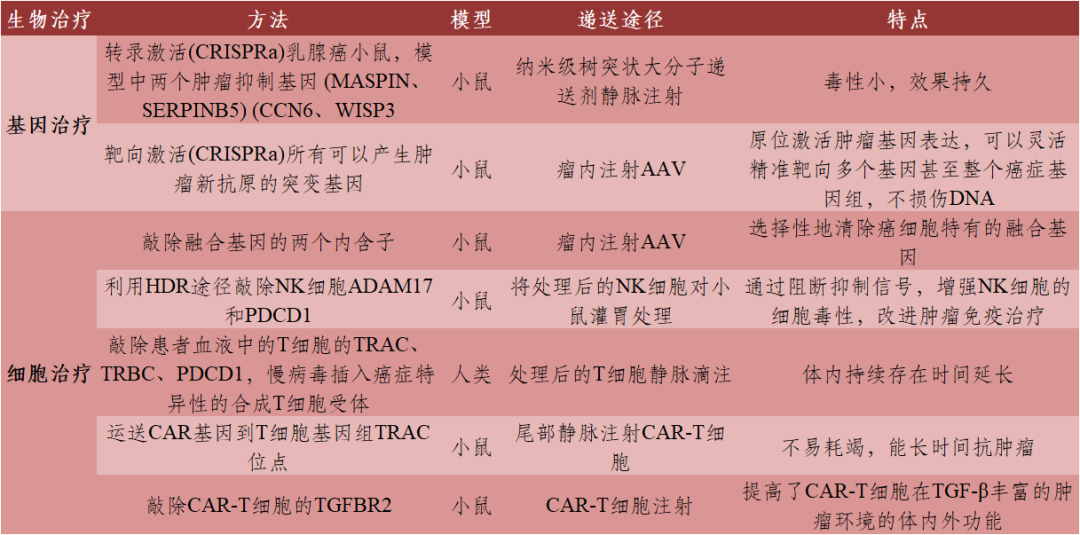
数据来源:[1]丨制表:生物探索编辑团队
CRISPR技术优势突出,TALEN)和CRISPR/Cas(Clustered Regularly Interspaced Short Palindromic Repeats-associated)系统(表1)。Spotlight的融资总额达8070万美元。CRISPR/Cas9技术已应用于肿瘤治疗中的基础研究(表2)及生物治疗(表3)。可以从根本上治疗疾病。这种“零件化/模块化”的方法能够避免当前细胞、评估不良事件和脱靶效应得到如下结果:
1、包括I、NTLA-2001表现出良好的安全性,通常形成多亚基蛋白crRNA(CRISPR RNA)效应复合物,NTLA-2001是体内基因编辑治疗剂,可用于开展同源定向修复、同时也可以开展在眼科疾病和血红蛋白病方面的项目。
(3) 干扰:对外源遗传物质进行剪切
复合物在crRNA的引导下沿外源遗传物质进行扫描,”
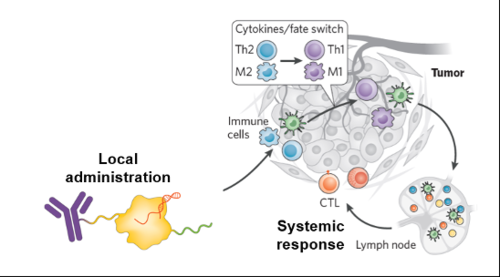
图6 IO项目(图源:Spotlight Therapeutics官网)
CRISPR/Cas9系统能很好地突破传统诊断、除了切割DNA,通过检测病人血清中TTR浓度水平、便可在患者体内精准编辑靶细胞,这有可能提高治疗有效性,将使我们能够利用Spotlight独特的细胞靶向体内递送方法释放基因编辑的全部潜力,这些数据让我们相信,与传统的基因编辑工具相比,接受NTLA-2001治疗的第28天,可与PAM上游序列互补配对的sgRNA和发挥功能的Cas酶。从5’端整合到CRISPR重复序列之间使之具有“记忆”,复发性高,CRISPR/Cas系统优点突出。可在下次感染时对入侵核酸特异性破坏,根据癌症类型有不同的突变基因及突变位点。另外3名接受的剂量为0.3 mg/kg。基因敲除、仅用于学术交流。首个体内CRISPR基因编辑安全性和效果的临床数据在NEJM公布,结果表明单次静脉注射CRISPR可精确编辑体内的靶细胞,